再生医療や創薬の分野において、エクソソーム(細胞外小胞)の治療応用への期待は日増しに高まっています。しかし、研究室レベルでの成果を実用化や商用生産へとつなげる段階で、多くの開発担当者が直面するのが「エクソソーム製造のスケールアップ課題」という大きな壁です。小規模な培養フラスコではうまくいっていた手法も、大量生産となると品質の維持やコスト面で予期せぬ問題が発生することが少なくありません。
本記事では、製薬企業やCDMOでプロセス開発に携わる皆様に向けて、アップストリームからダウンストリーム、そして品質管理に至るまでの具体的な技術的課題を詳説します。また、それらを解決するための最新の製造技術やソリューションについても解説しますので、スケーラブルな製造体制構築の一助としてお役立てください。
エクソソーム製造のスケールアップにおける最大の課題は「品質の均一性」と「製造コスト」の両立

エクソソームの製造プロセスをラボスケールから商用レベルへと拡大する際、単に培養液の量を増やせば良いというわけではありません。開発担当者が最も頭を悩ませるのは、生産規模を拡大しつつ、いかにして「品質の均一性」を維持し、かつ事業として成立する「製造コスト」に抑えるかという点です。ここでは、スケールアップ時に直面する根本的な課題について掘り下げていきましょう。
ラボスケールから商用生産へ移行する際の収率低下(歩留まり)の問題
研究段階の小規模な系では高い回収率を誇っていたプロセスでも、スケールアップに伴い収率が大幅に低下するケースが散見されます。例えば、大量の培養液を処理する過程で、配管への吸着やフィルターでの損失、あるいは精製工程の多段化によるロスが積み重なることが主な要因です。
特にダウンストリーム工程において、処理量が増えるほど工程ごとのわずかなロスが最終的な収量に甚大な影響を及ぼします。高い歩留まりを維持するためには、プロセス全体を通じた最適化と、スケールアップに適した機器の選定が不可欠です。
ロット間差をなくし均質なエクソソームを安定供給する難しさ
細胞という「生き物」を工場とするエクソソーム製造において、ロット間差(Batch-to-Batch variation)の制御は極めて困難かつ重要な課題です。培養スケールが大きくなると、タンク内の撹拌効率や酸素供給、pH分布などの不均一性が生じやすくなり、これが細胞の状態変化を引き起こします。
その結果、分泌されるエクソソームの粒子数や内包成分、表面マーカーの発現量などにバラつきが生じる可能性があります。医薬品としての承認を得るためには、いつ製造しても同じ品質であることを保証する堅牢なプロセスの構築が求められます。
GMP製造に耐えうるコスト構造(CoG)の確立
商用化を見据えた場合、GMP(Good Manufacturing Practice)準拠の製造環境下で、採算の取れる製造原価(CoG: Cost of Goods)を実現しなければなりません。しかし、エクソソーム製造には高価な培地や成長因子、特殊な精製試薬が必要となることが多く、これがコストを押し上げる要因となります。
また、スケールアップに伴う設備投資や、厳格な品質管理にかかるコストも無視できません。開発の初期段階から、将来的なコスト構造を意識し、安価で入手可能な原材料への切り替えや、効率的な製造プロセスの設計を行うことが、事業の成否を分けるポイントとなるでしょう。
培養工程(アップストリーム)における技術的課題
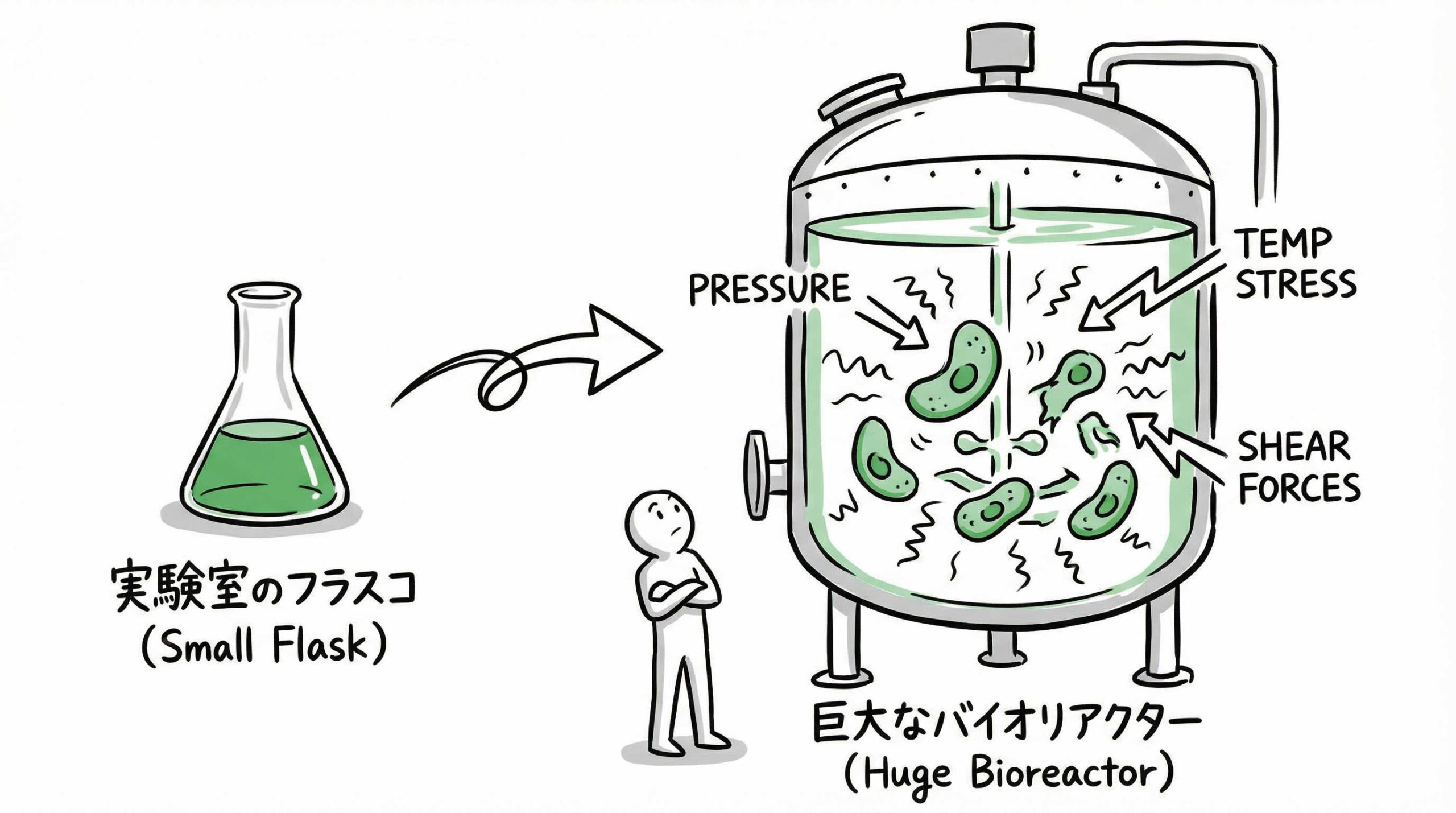
培養工程(アップストリーム)は、エクソソームの質と量を決定づける出発点です。しかし、大量培養を行おうとすると、実験室のフラスコ培養とは全く異なる物理的・環境的要因が細胞に影響を与えます。ここでは、培養方式の変更や環境制御において、具体的にどのような技術的ハードルが存在するのかを見ていきましょう。
2次元平面培養(フラスコ)から3次元培養への移行に伴う細胞挙動の変化
従来の研究で用いられてきたフラスコ等の2次元平面培養は、表面積に限界があるため大量生産には不向きです。そのため、バイオリアクターを用いた3次元培養への移行が検討されますが、足場(スキャフォールド)の状態や細胞同士の接触環境が変化することで、細胞の挙動が変わってしまうことがあります。
細胞の微小環境の変化は、エクソソームの分泌量や特性に直接影響を与えかねません。したがって、2次元から3次元へ移行する際には、細胞の増殖性だけでなく、産生されるエクソソームの品質が同等であることを慎重に検証する必要があります。
撹拌型バイオリアクターにおけるシェアストレス(せん断力)の制御
大量培養のために撹拌型バイオリアクター(STR)を使用する場合、培地を均一にするための撹拌翼の回転が、細胞に対して物理的なシェアストレス(せん断力)を与えます。過度なストレスは細胞にダメージを与え、アポトーシス(細胞死)を誘発したり、不必要な細胞破片(デブリ)を増加させたりする原因となります。
また、ストレスを受けた細胞が分泌するエクソソームは、通常とは異なるメッセージ(積荷)を含む可能性も指摘されています。スケールアップにおいては、十分な混合効率を確保しつつ、細胞へのダメージを最小限に抑える撹拌条件の最適化が求められます。
マイクロキャリアを用いた懸濁培養における細胞密度の限界
接着依存性細胞を懸濁培養する際に用いられるマイクロキャリア(微小担体)ですが、タンク内での細胞密度を高めようとすると限界に直面します。キャリア同士の衝突による細胞剥離や、高密度化に伴う栄養源・酸素の供給不足が局所的に発生するためです。
単位体積あたりの生産性を上げるには細胞密度を高める必要がありますが、マイクロキャリア法では表面積の物理的な制約があります。これにより、期待するほどの生産量増加が得られない場合があり、より効率的な培養システムの検討が必要になることもあります。
大量培養時における培地交換の効率化とコスト削減
培養スケールが数百リットル、数千リットルとなると、培地交換にかかるコストと労力は膨大なものになります。バッチ培養やフェドバッチ培養では、老廃物の蓄積により培養期間が制限されがちです。
一方で、常に新鮮な培地を供給し続けるパフュージョン(灌流)培養は、高密度培養を維持できる反面、大量の培地を消費します。培地コストは製造原価の大きな割合を占めるため、培地使用量を抑えつつ生産性を最大化するプロセスの開発は、経済的な観点からも極めて重要な課題です。
動物由来成分を含まない(Xeno-free/AOF)培地での増殖性維持
臨床応用を前提とする場合、安全性確保のためにウシ胎児血清(FBS)などの動物由来成分を含まないXeno-free(異種動物由来成分不含)培地や、AOF(Animal Origin Free)培地の使用が推奨されます。しかし、これらの培地への切り替えは一筋縄ではいきません。
血清を含まない培地では、細胞の増殖速度が低下したり、接着性が弱まったりすることがあります。また、血清中の成分が担っていた保護作用がなくなることで、細胞が物理的ストレスに弱くなることもあります。商用生産に向けては、Xeno-free環境下でも安定して増殖し、高品質なエクソソームを産生できる馴化(じゅんか)プロセスや培地選定が必須です。
精製工程(ダウンストリーム)における技術的課題
培養液に含まれるエクソソームは微量であり、かつ培養上清には多種多様な不純物が混在しています。数百リットル規模の培養液から、目的のエクソソームだけを高純度かつ高収率で回収するダウンストリーム工程は、スケールアップにおいて最も技術的難易度が高い領域の一つです。
超遠心分離法における処理能力の限界とスケーラビリティの欠如
ラボレベルで標準的に用いられている超遠心分離法は、処理できる液量に限りがあり、操作も煩雑で自動化が困難です。さらに、超遠心機そのものが高価であり、スケールアップのために台数を増やすことは現実的ではありません。
また、長時間にわたる高重力負荷がエクソソームの構造にダメージを与えたり、凝集を引き起こしたりするリスクもあります。そのため、商用生産においては、超遠心法に代わるスケーラブルな分離技術(クロマトグラフィーやTFFなど)への転換が不可欠となります。
大量液量処理時における処理時間の長期化とエクソソームの失活
大量の培養上清を処理する場合、精製工程全体にかかる時間が長くなりがちです。常温環境下で長時間放置されると、エクソソーム自体が変性したり、内包されているRNAやタンパク質が分解されたりして、生理活性(機能)が低下する恐れがあります。
特に、連続的な処理が難しいバッチ式の精製プロセスでは、待機時間が長くなる傾向があります。活性を維持したまま製品化するためには、処理時間の短縮化や、低温環境下での迅速な処理が可能なプロセス設計が求められます。
不純物(タンパク質・核酸・ウイルス)とエクソソームの効率的な分離
培養上清中には、エクソソームとサイズや密度が類似した不純物(宿主細胞由来タンパク質、DNA、ウイルス、アポトーシス小体など)が多数含まれています。これらを効率的に除去しつつ、エクソソームのみを回収することは容易ではありません。
例えば、サイズ排除クロマトグラフィーだけではサイズが近い不純物を取り除けず、イオン交換クロマトグラフィーでは条件検討が複雑になります。高純度な製品を得るためには、複数の精製手法を組み合わせるなどの工夫が必要ですが、工程が増えればそれだけ収率低下のリスクも高まるというジレンマがあります。
濃縮・精製プロセスにおけるフィルター目詰まり(ファウリング)の回避
大量の培養液を濃縮・ろ過する際、フィルターの目詰まり(ファウリング)は避けて通れない問題です。目詰まりが起きると、ろ過圧力が上昇し、処理速度が低下するだけでなく、フィルター交換による中断や製品ロスが発生します。
特に、タンパク質濃度が高い溶液や、粘性が高い溶液を扱う場合に顕著です。スケールアップ時には、適切な膜面積の選定や、目詰まりを抑制するクロスフローろ過(TFF)などの技術導入、あるいは前処理工程での清澄化の最適化が重要な鍵となります。
品質管理(QC)と規制対応における課題
製造したエクソソームが医薬品として認められるためには、その品質を科学的に証明し、規制当局の基準を満たす必要があります。しかし、エクソソームという物質自体の複雑さと多様性が、品質管理(QC)を非常に難しいものにしています。ここでは、品質評価と規制対応における特有の課題について解説します。
エクソソームの不均一性がもたらす特性解析(キャラクタリゼーション)の複雑さ
エクソソームは単一の分子ではなく、サイズや含有成分が異なる不均一な集団(ヘテロジェニシティ)です。このため、「何をもって純度が高いとするか」「どの成分を指標とするか」という特性解析(キャラクタリゼーション)が非常に複雑になります。
単一の解析手法では全体像を把握しきれないため、ナノトラッキング解析(NTA)、電子顕微鏡、ウエスタンブロッティング、質量分析など、多角的な手法を組み合わせて評価する必要があります。スケールアップした製品が、開発初期のものと同一の特性を持っていることを証明するには、高度な解析技術とデータの蓄積が必要です。
標準化された定量法・力価試験(ポテンシーアッセイ)の確立
医薬品としての有効性を保証するためには、物理的な量(粒子数やタンパク質量)だけでなく、生物学的な活性(ポテンシー)を測定する必要があります。しかし、エクソソームの作用機序(MOA)は多岐にわたり、どの機能を指標にすればよいかが明確でない場合も少なくありません。
標準化された定量法や力価試験が確立されていない現状では、各社が独自にアッセイ系を開発し、その妥当性を規制当局に説明する必要があります。安定して実施可能で、かつ臨床効果と相関するポテンシーアッセイの確立は、実用化に向けた大きなハードルの一つです。
製造プロセス変更時における同等性・同質性の証明
スケールアップや製造場所の変更に伴い、製造プロセスを変更することはよくあります。この際、変更前後の製品が品質的に同等・同質であることを証明する「同等性評価」が義務付けられています。
しかし、エクソソームのような複雑な製剤において、完全な同等性を証明することは容易ではありません。わずかなプロセスの違いが、予期せぬ品質特性の変化をもたらす可能性があるからです。変更管理を適切に行い、科学的根拠に基づいた同等性データを提示できる体制を整えておくことが、スムーズな開発進行には不可欠です。
スケールアップ課題を解決する最新の製造技術とソリューション
これまで述べてきた数々の課題に対し、業界では技術革新が進み、スケールアップを可能にする新たなソリューションが登場しています。ラボスケールの限界を突破し、商用生産への道を開くための主要な技術をご紹介します。これらの技術導入は、品質の安定化とコストダウンの両面に寄与するでしょう。
ホローファイバー(中空糸)バイオリアクターによる高密度培養の実現
従来のタンク型リアクターに代わり注目されているのが、ホローファイバー(中空糸)バイオリアクターです。無数の中空糸の表面に細胞を高密度に接着させ、培地を循環させることで、コンパクトなスペースで大量の細胞を培養できます。
このシステムの最大の利点は、細胞へのシェアストレスを低減しつつ、培養上清中のエクソソーム濃度を飛躍的に高められる点です。結果として、下流工程での濃縮負担が減り、培地使用量も削減できるため、効率的な生産体制の構築に貢献します。
接線流ろ過(TFF)システムの導入による連続的な濃縮・洗浄
精製工程の効率化において、接線流ろ過(Tangential Flow Filtration: TFF)システムは今や必須の技術となりつつあります。TFFは、膜の表面に平行に液体を流すことで目詰まりを防ぎながら、連続的に濃縮と洗浄(バッファー交換)を行うことができます。
スケールアップが容易であり、処理量に応じて膜面積を増やすだけで対応可能です。また、閉鎖系での操作が可能なため、無菌性の担保もしやすく、GMP製造に適したプロセスとして広く採用されています。
クロマトグラフィー(AEX/SEC)を用いた高純度かつ自動化された精製
高純度なエクソソームを得るために、陰イオン交換クロマトグラフィー(AEX)やサイズ排除クロマトグラフィー(SEC)の活用が進んでいます。これらはタンパク質医薬品の製造で実績のある技術であり、自動化システムへの組み込みも容易です。
特に、特定のリガンドを用いたアフィニティークロマトグラフィーなどは、目的のエクソソームを選択的に回収する強力なツールとなります。これらの技術を組み合わせることで、超遠心法では達成できない純度と再現性を実現し、商用レベルの製造が可能になります。
シングルユース技術の採用によるコンタミネーションリスクの低減
製造ラインの洗浄や滅菌バリデーションにかかる時間とコストを削減するため、接液部を使い捨てにするシングルユース技術の採用が標準的になりつつあります。バッグ、チューブ、コネクター、フィルターなどをシングルユース化することで、コンタミネーション(汚染)のリスクを極限まで低減できます。
また、製品切り替え時のセットアップ時間が短縮されるため、多品種製造や迅速な製造ロットの回転が可能となり、全体的な生産効率の向上につながります。
効率的な事業化に向けたCDMO(医薬品開発製造受託機関)の活用

エクソソーム製造のスケールアップには、高度な専門知識と高額な設備投資が必要です。これらをすべて自社単独で賄うことは、リソースの限られた企業にとって大きなリスクとなります。そこで重要な選択肢となるのが、CDMO(医薬品開発製造受託機関)の活用です。外部の専門性をうまく取り入れることで、事業化を加速させるポイントを整理します。
プロセス開発(PD)段階からGMP製造までのシームレスな移行
経験豊富なCDMOは、研究段階のプロセスをGMP製造に適したプロセスへと最適化するノウハウを持っています。プロセス開発(PD)の初期段階からCDMOと連携することで、スケールアップ時に起こりうる問題を予見し、事前に対策を講じることが可能です。これにより、開発の後戻りを防ぎ、スムーズに治験薬製造や商用生産へと移行することができます。
専門的な設備投資リスクの回避と開発スピードの向上
GMP準拠の製造施設(CPC)を自社で建設・維持するには、莫大な初期投資とランニングコストがかかります。CDMOを活用すれば、自社で設備を抱えることなく、最新の製造技術や分析機器を利用することができます。
これにより、固定費を変動費化し、財務リスクを低減できるだけでなく、設備建設にかかるリードタイムを省略できるため、市場投入までの期間を大幅に短縮することが可能になります。
規制当局への対応経験が豊富なパートナー選定の重要性
再生医療等製品や生物由来製品に関する規制は国ごとに異なり、かつ頻繁に改正されます。規制対応の経験が豊富なCDMOは、当局との相談や申請資料の作成において強力なパートナーとなります。
特に、品質試験(QC)や安全性試験のデータ整備においては、過去の査察対応経験などが活かされます。自社の製品特性を理解しつつ、規制要件を熟知したCDMOを選定することは、承認取得の確度を高める上で極めて重要です。
まとめ
エクソソーム製造のスケールアップは、再生医療の実用化における最大の関門の一つですが、決して乗り越えられない壁ではありません。品質の均一性と製造コストの課題に対し、3次元培養やTFF、クロマトグラフィーといった最新技術を適切に組み合わせることで、解決への道筋は見えてきます。
また、自社リソースのみに固執せず、専門的なノウハウを持つCDMOを戦略的に活用することも、成功への近道と言えるでしょう。技術的なハードルを一つひとつクリアし、確実なスケールアップを実現することが、革新的な治療法を患者様に届けるための第一歩となります。
エクソソーム製造のスケールアップ課題についてよくある質問

Q. スケールアップを検討し始める最適なタイミングはいつですか?
- 基本的な製造プロセス(Proof of Concept)が確立し、前臨床試験(動物試験)へ進む段階での検討開始を推奨します。治験薬製造(GMP)直前になってからの変更は、同等性評価のハードルを上げ、開発遅延の原因となります。
Q. 2次元培養から3次元培養への移行にかかる期間の目安は?
- 細胞種や条件によりますが、条件検討から安定稼働まで通常6ヶ月〜1年程度を見込む必要があります。細胞の馴化や品質評価に十分な時間を確保することが重要です。
Q. エクソソームの品質規格はどのように設定すればよいですか?
- 現時点では公定書のような統一規格はありません。国際細胞外小胞学会(ISEV)のガイドライン(MISEV)などを参考にしつつ、自社製品の特性(純度、粒子数、マーカー発現、活性など)に基づき、規制当局と相談しながら設定する必要があります。
Q. CDMOを選ぶ際に最も重視すべきポイントは何ですか?
- 「エクソソーム製造の実績」と「柔軟な対応力」です。特に、スケールアップの経験があるか、そして開発段階の変更に対して柔軟にプロセス調整を行える技術力があるかを確認しましょう。
Q. 動物由来成分を含まない(AOF)培地は必須ですか?
- 必須ではありませんが、臨床応用時の安全性リスク(未知のウイルス感染など)を低減するため、規制当局からは強く推奨されています。将来的なグローバル展開を考えるなら、早期にAOF培地へ切り替えることが望ましいでしょう。
<script type="application/ld+json">
{
"@context": "https://schema.org",
"@type": "FAQPage",
"mainEntity": [
{
"@type": "Question",
"name": "スケールアップを検討し始める最適なタイミングはいつですか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "基本的な製造プロセス(Proof of Concept)が確立し、前臨床試験(動物試験)へ進む段階での検討開始を推奨します。治験薬製造(GMP)直前になってからの変更は、同等性評価のハードルを上げ、開発遅延の原因となります。"
}
},
{
"@type": "Question",
"name": "2次元培養から3次元培養への移行にかかる期間の目安は?",
"acceptedAnswer": {
"@type": "Answer",
"text": "細胞種や条件によりますが、条件検討から安定稼働まで通常6ヶ月〜1年程度を見込む必要があります。細胞の馴化や品質評価に十分な時間を確保することが重要です。"
}
},
{
"@type": "Question",
"name": "エクソソームの品質規格はどのように設定すればよいですか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "現時点では公定書のような統一規格はありません。国際細胞外小胞学会(ISEV)のガイドライン(MISEV)などを参考にしつつ、自社製品の特性(純度、粒子数、マーカー発現、活性など)に基づき、規制当局と相談しながら設定する必要があります。"
}
},
{
"@type": "Question",
"name": "CDMOを選ぶ際に最も重視すべきポイントは何ですか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "「エクソソーム製造の実績」と「柔軟な対応力」です。特に、スケールアップの経験があるか、そして開発段階の変更に対して柔軟にプロセス調整を行える技術力があるかを確認しましょう。"
}
},
{
"@type": "Question",
"name": "動物由来成分を含まない(AOF)培地は必須ですか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "必須ではありませんが、臨床応用時の安全性リスク(未知のウイルス感染など)を低減するため、規制当局からは強く推奨されています。将来的なグローバル展開を考えるなら、早期にAOF培地へ切り替えることが望ましいでしょう。"
}
}
]
}
</script>



