再生医療の分野において、幹細胞そのものを用いる治療から、細胞が分泌する「エクソソーム」を活用したCell-free therapy(細胞を用いない治療)へと、大きなパラダイムシフトが起きつつあります。エクソソームは、細胞間コミュニケーションの重要なメディエーターとして機能し、その生物学的機能の解明が進むにつれて、難治性疾患に対する新たな治療モダリティとしての期待が高まっています。
特に、間葉系幹細胞(MSC)由来のエクソソームは、高い組織修復能力と免疫調節能を持ちながら、細胞治療特有の課題を克服する可能性を秘めています。本記事では、再生医療の研究開発や臨床応用に携わる専門家の皆様に向けて、エクソソームの基礎的な生物学的機能から、最新の治療応用、DDS(ドラッグデリバリーシステム)への展開、そして社会実装に向けた課題までを網羅的に解説します。次世代の医療を切り拓くための判断材料として、ぜひお役立てください。
エクソソームの生物学的機能と治療応用の展望:次世代モダリティとしての可能性
近年、再生医療の研究開発において、エクソソームは「次世代のモダリティ」として熱い視線を集めています。これまで幹細胞移植の効果と考えられていた現象の多くが、実はエクソソームをはじめとする細胞外小胞(EVs)によるパラクライン効果であることが明らかになってきたからです。ここでは、細胞治療からCell-free therapyへの移行が進む背景と、その優位性や将来展望について概説します。
MSC由来エクソソームを中心としたCell-free therapyへのパラダイムシフト
かつて再生医療の主役は、生きた細胞そのものを移植する手法でした。しかし、移植された幹細胞の多くは体内で長期間生着せず、むしろ細胞が分泌する因子が治療効果の主体であることが分かってきました。この発見により、細胞そのものではなく、その有効成分であるエクソソームを投与する「Cell-free therapy」へのパラダイムシフトが加速しています。
特にMSC(間葉系幹細胞)由来のエクソソームは、親細胞と同様の組織修復能や抗炎症作用を持つことが多数報告されています。細胞移植に伴う複雑な制御を必要とせず、有効成分のみを精製して利用するという考え方は、医薬品開発の観点からも極めて合理的であり、創薬の新たな潮流を生み出しています。
従来の細胞治療と比較した際の安全性とハンドリングの優位性
エクソソームを利用する最大の利点は、生きた細胞を用いる従来の治療法と比較して、安全性と取り扱いの面で圧倒的な優位性がある点です。
- 腫瘍化リスクの低減: 細胞核を持たないため、投与後に癌化するリスクや、予期せぬ分化をする懸念が極めて低くなります。
- 免疫原性の低さ: MHCクラスI/IIの発現が低い、あるいは制御可能であるため、同種移植においても免疫拒絶反応が起こりにくいとされています。
- 保存・輸送の利便性: 冷凍・解凍が可能であり、生細胞のように厳密な温度管理や生存率の維持に腐心する必要がありません。これにより、オフザシェルフ製剤としての供給が可能となります。
臨床応用における現在の到達点と今後の市場予測
現在、エクソソームを用いた治療法の開発は、基礎研究から臨床試験へとフェーズを移行させつつあります。主要なデータベース(ClinicalTrials.gov等)を参照すると、がん、神経疾患、呼吸器疾患など多岐にわたる領域で臨床試験が進行中です。
市場予測においても、エクソソーム関連市場は今後数年で爆発的な成長が見込まれています。診断薬としての応用だけでなく、治療薬としての承認事例が出始めれば、その市場規模は数千億円規模に達すると予測されます。大手製薬企業とベンチャーの提携も活発化しており、実用化に向けた競争は激化の一途をたどるでしょう。
エクソソームの生物学的機能と分子メカニズムの基礎

エクソソームの治療応用を考える上で、その生成過程や作用機序を深く理解することは不可欠です。直径30〜150nm程度のこの微小な小胞は、単なる細胞の「ゴミ」ではなく、高度に制御された情報伝達ツールです。ここでは、エクソソームの生合成から標的細胞への作用に至るまでの分子メカニズムについて、生物学的な視点から詳しく解説します。
多胞体(MVB)由来の生合成経路と分泌メカニズム
エクソソームは、細胞膜から直接出芽するマイクロベシクルとは異なり、エンドサイトーシス経路を経て形成されます。細胞膜の陥入によって形成された初期エンドソームが成熟し、その内膜がさらに陥入することで、内腔小胞(ILVs)を含む多胞体(MVB)が形成されます。
このMVBが細胞膜と融合することで、ILVsが細胞外に放出されたものがエクソソームです。この過程には、ESCRT(Endosomal Sorting Complex Required for Transport)複合体が関与する経路と、セラミドなどが関与するESCRT非依存的な経路が存在します。この複雑な生合成プロセスにより、特定のタンパク質や核酸が選択的に積み込まれるのです。
標的細胞への特異的結合と主要な取り込み経路
放出されたエクソソームは、ランダムに細胞に取り込まれるわけではありません。表面に存在する特定の分子を介して、標的となる細胞を認識し、結合します。
- テトラスパニン類(CD9, CD63, CD81等): エクソソームの表面マーカーとして知られ、細胞接着に関与します。
- インテグリン: 特定の組織へのホーミング(指向性)を決定づける重要な因子です。例えば、特定のインテグリン発現パターンを持つエクソソームは、肺や肝臓など特定の臓器に集積しやすいことが報告されています。
結合後は、膜融合やエンドサイトーシス(クラスリン依存性、カベオラ依存性など)によって標的細胞内に取り込まれ、その機能を及ぼします。
miRNAをはじめとする内包カーゴによる細胞間情報伝達
エクソソームの最も重要な機能の一つが、内包するカーゴ(積み荷)による細胞間情報伝達です。これにはmRNA、miRNA(マイクロRNA)、タンパク質、脂質などが含まれます。
特に注目されているのがmiRNAです。エクソソームによって運ばれたmiRNAは、標的細胞内で特定の遺伝子のメッセンジャーRNA(mRNA)に結合し、その翻訳を抑制または分解することで、遺伝子発現を調節します。これは、あたかも遠隔地の細胞に対して指令を送るようなものであり、エピジェネティックな制御機構として機能しています。このメカニズムを利用して、疾患特異的なmiRNAを補充、あるいは阻害することが治療戦略となり得ます。
免疫調節機能と組織修復・再生誘導の作用機序
MSC由来のエクソソームなどは、強力な免疫調節機能と組織修復能を有しています。具体的には、炎症性マクロファージ(M1型)から抗炎症性マクロファージ(M2型)への極性転換を誘導したり、制御性T細胞(Treg)の分化を促進したりすることで、過剰な炎症反応を鎮静化します。
また、血管新生因子や細胞増殖因子を運搬することで、損傷した組織の血管網を再構築し、細胞死(アポトーシス)を抑制して組織再生を促します。これらの作用は単一の分子によるものではなく、エクソソームに含まれる複合的な成分がオーケストラのように協調して働くことで実現されています。
疾患領域別に見るエクソソーム治療の臨床応用と研究事例
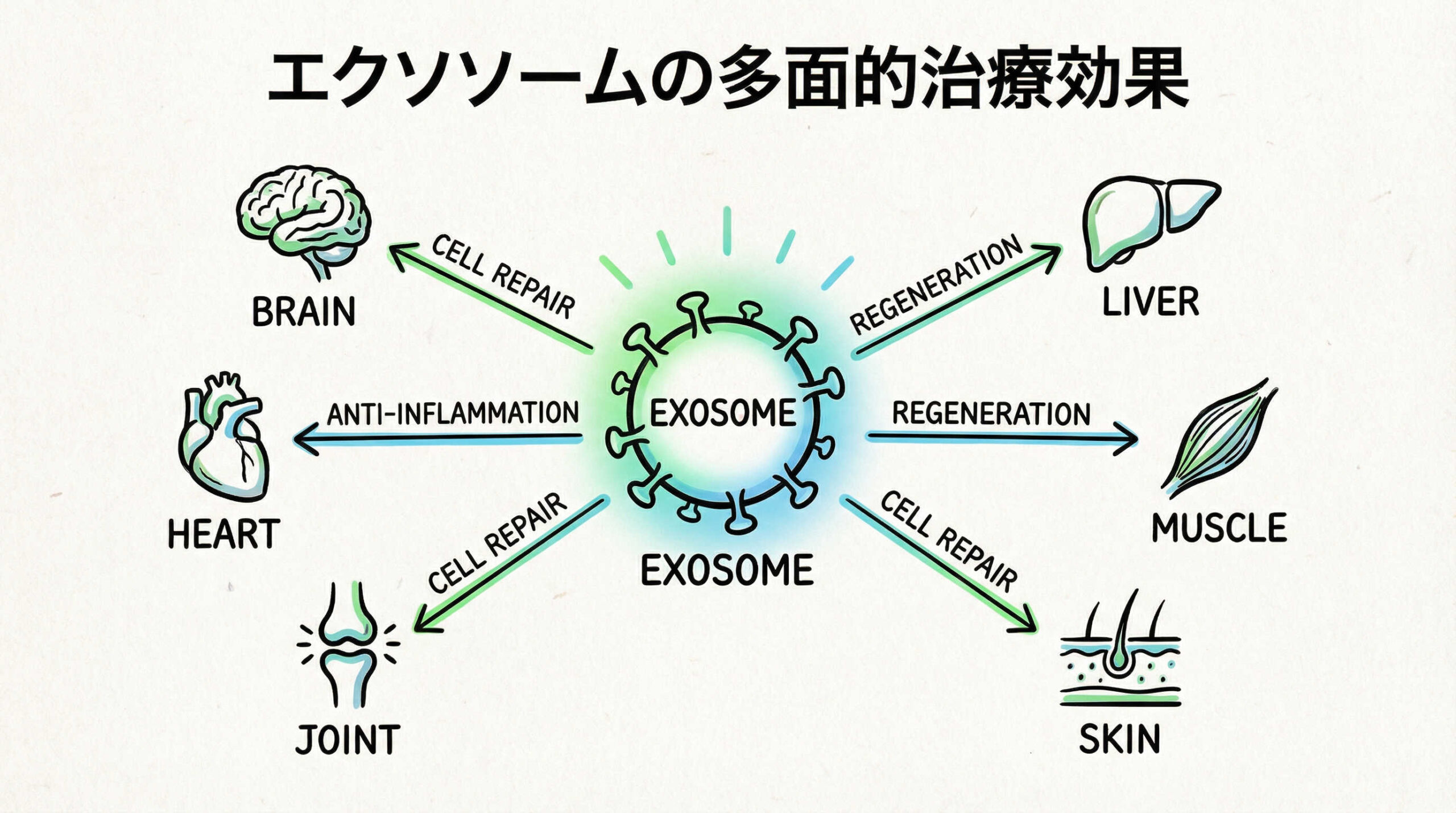
エクソソームの持つ多面的な生物学的機能は、現在、多くの難治性疾患に対する新たな治療アプローチとして研究されています。特に、従来の低分子医薬や抗体医薬では到達困難な組織への送達や、複雑な病態の制御において期待が寄せられています。ここでは、主要な疾患領域における臨床応用と研究の最前線を紹介します。
神経疾患領域:脳梗塞・脊髄損傷・アルツハイマー病へのアプローチ
中枢神経系疾患は、血液脳関門(BBB)の存在により薬剤送達が困難な領域ですが、エクソソームはこの障壁を通過できる可能性があります。
- 脳梗塞: MSC由来エクソソームが神経細胞のアポトーシスを抑制し、神経可塑性を高めて機能回復を促進することが動物モデルで示されています。
- アルツハイマー病: 異常タンパク質の蓄積抑制や、ミクログリアによる貪食能の調節など、病態進行を遅らせるアプローチが研究されています。
- 脊髄損傷: 抗炎症作用と軸索伸展の促進により、運動機能の改善を目指す研究が進んでいます。
循環器・代謝疾患領域:心筋梗塞後の再生と血管新生
心血管領域においても、エクソソームによる再生医療への期待は高まっています。心筋梗塞後の心不全は予後不良な疾患ですが、エクソソーム治療は心筋再生の新たな希望となり得ます。
虚血再灌流障害モデルにおいて、エクソソーム投与が心筋細胞死を減少させ、線維化を抑制することが報告されています。さらに、血管新生を強力に誘導することで、虚血部位への血流回復を助けます。これは、内包されるmiRNA(miR-21やmiR-126など)が主要な役割を果たしていると考えられており、カテーテルを用いた局所投与などの臨床応用が検討されています。
炎症・免疫疾患領域:GVHDや自己免疫疾患に対する免疫制御
自己免疫疾患や移植片対宿主病(GVHD)のような、免疫系が暴走する病態に対して、エクソソームの免疫調節能が応用されています。
特にステロイド抵抗性の重症GVHDに対して、MSC由来エクソソームを投与し、症状が改善したという臨床報告は業界に衝撃を与えました。エクソソームはT細胞の増殖を抑制し、炎症性サイトカインの産生を抑えることで、免疫寛容を誘導します。全身投与が可能であり、副作用のリスクも比較的低いため、既存の免疫抑制剤に代わる、あるいは併用する新たな選択肢として開発が進められています。
呼吸器疾患領域:COPDや間質性肺炎における抗炎症・抗線維化
肺は広大な表面積を持ち、エクソソームの吸入投与などが可能な臓器です。慢性閉塞性肺疾患(COPD)や特発性肺線維症、さらにはCOVID-19に伴う重篤な肺炎に対しても研究が行われています。
MSC由来エクソソームは、肺胞上皮細胞の保護、炎症細胞の浸潤抑制、そして線維化の防止といった効果を発揮します。特に、急性呼吸窮迫症候群(ARDS)モデルにおいて、肺の透過性亢進を抑制し、酸素化を改善する効果が示唆されており、呼吸器領域におけるアンメットメディカルニーズを満たす製剤として期待されています。
新規DDSキャリアとしてのエンジニアリングエクソソームの開発
天然のエクソソームをそのまま利用するだけでなく、その機能を強化・改変した「エンジニアリングエクソソーム」の開発も活発です。これはエクソソームを天然のナノカプセル(DDSキャリア)として捉え、薬剤を搭載したり、指向性を高めたりする技術です。合成脂質ナノ粒子(LNP)と比較しても、生体適合性や低免疫原性の面で有利とされています。
低分子化合物・核酸医薬の搭載技術と送達効率
エクソソーム内部へ治療用分子を搭載する技術は、DDS開発の核心です。低分子化合物(抗がん剤など)や核酸医薬(siRNA、miRNA、mRNA)を効率よく封入するために、様々な手法が開発されています。
- エレクトロポレーション(電気穿孔法): 電気パルスで膜に一時的な穴を開けて導入する方法。
- ソニケーション(超音波処理): 超音波で膜構造を一時的に不安定化させる方法。
- 親細胞への導入: 親細胞に薬剤を取り込ませたり、プラスミドを導入して特定のカーゴを産生させ、分泌されるエクソソームに自然に内包させる方法。
これらの技術により、標的細胞へ高濃度かつ選択的に薬剤を届けることが可能になります。
表面修飾による標的指向性の向上と体内動態の制御
エクソソームの表面タンパク質を遺伝子工学的に改変することで、特定の臓器やがん細胞への指向性(ターゲティング能)を飛躍的に向上させることができます。
例えば、エクソソーム膜表面にあるLamp2bなどのタンパク質に、がん細胞特異的なペプチドや抗体を融合発現させる技術があります。これにより、投与されたエクソソームが全身に分散することなく、標的部位に集積しやすくなります。また、PEG(ポリエチレングリコール)修飾などで血中滞留性を高め、マクロファージによる捕捉を回避する「ステルス化」の研究も進んでいます。体内動態を制御することで、副作用の低減と薬効の最大化が期待できます。
血液脳関門(BBB)透過性を活用した中枢神経系疾患への応用
中枢神経系疾患の治療における最大の壁は、血液脳関門(BBB)です。エンジニアリングエクソソームは、このBBBを突破する「トロイの木馬」としての役割が期待されています。
狂犬病ウイルス由来の糖タンパク質(RVG)ペプチドなどを表面に提示させたエクソソームは、アセチルコリン受容体を介してBBBを通過し、脳内へ薬剤を送達できることが報告されています。この技術が確立されれば、これまで治療法が限られていた脳腫瘍や神経変性疾患に対して、核酸医薬などの画期的な治療薬を届けることが可能になり、医療に革命をもたらすでしょう。
エクソソーム製剤の社会実装に向けた課題と製造プロセス
エクソソームの治療応用には大きな可能性がありますが、医薬品として社会実装するためには、製造プロセスと品質管理において解決すべき課題が残されています。研究室レベルの小規模な実験から、GMP(Good Manufacturing Practice)準拠の商業生産へと移行するには、高度な技術革新と規制への対応が必要です。
医療グレードでの大量製造と分離精製技術(SEC・TFF等)の最適化
臨床使用に耐えうる量と質のエクソソームを製造するためには、効率的な培養と精製技術が不可欠です。
- 大量培養: 従来の2次元培養(フラスコ)では限界があるため、バイオリアクターを用いた3次元培養や中空糸培養など、高密度培養技術の導入が進んでいます。
- 分離精製: 超遠心法は研究用としては標準的ですが、スケーラビリティに欠けます。産業用には、タンジェンシャルフローろ過(TFF)やサイズ排除クロマトグラフィー(SEC)、あるいはこれらを組み合わせた連続プロセスが最適化されつつあります。不純物を除去しつつ、エクソソームの構造を破壊しない穏和な条件設定が求められます。
不均一性を考慮した品質評価(CMC)と特性解析の標準化
エクソソームは細胞由来の天然物であるため、本質的に不均一(ヘテロジェニアス)です。ロット間差を最小限に抑え、一定の品質を担保するためのCMC(Chemistry, Manufacturing and Control)戦略が重要になります。
粒子径分布、粒子数、タンパク質マーカー(CD9, CD63等)の確認に加え、単一粒子解析技術(ナノトラッキング解析など)を用いた詳細な特性解析が必要です。また、力価(ポテンシー)試験として、標的細胞への取り込み効率や、具体的な生物活性(例えば血管新生誘導能など)を定量的に評価する系の確立も急務となっています。
規制当局(PMDA/FDA)のガイドラインと安全性試験の要件
エクソソーム製剤は新しいモダリティであるため、規制当局(日本のPMDAや米国のFDAなど)によるガイドラインも現在進行形で整備されています。基本的には「生物由来製品」や「再生医療等製品」としての枠組みで評価されますが、細胞そのものではないため、独自の安全性試験が求められます。
特に、ウイルス安全性評価、免疫原性、体内分布試験などは厳格に審査されます。開発の早い段階から規制当局と対話を行い、どのようなデータが必要かを把握しておくことが、スムーズな承認取得への鍵となります。国際的な調和(ICHガイドライン等)の動向にも注視が必要です。
まとめ
本記事では、再生医療における次世代モダリティとして注目される「エクソソーム」について、その生物学的機能から治療応用、そして実用化に向けた課題までを解説しました。
エクソソームは、MSC由来の細胞修復能力や免疫調節機能を持ちながら、細胞治療の安全性リスクを低減できる画期的なツールです。脳梗塞や心筋梗塞、難治性免疫疾患など、多岐にわたる領域での臨床応用が期待されています。また、エンジニアリングによる高機能化は、DDSキャリアとしての可能性を広げ、創薬の新たな地平を切り拓くでしょう。
製造や規制のハードルは存在しますが、技術の進歩と共に解決されつつあります。エクソソームの生物学的機能と治療応用に関する研究は、今後ますます加速し、医療の未来を大きく変える可能性を秘めています。研究開発や事業化を検討される皆様にとって、今がまさに参入の好機と言えるでしょう。
エクソソームの生物学的機能と治療応用についてよくある質問

以下に、エクソソームの生物学的機能と治療応用に関して、業界関係者からよく寄せられる質問をまとめました。
-
MSC由来エクソソームと他の細胞由来エクソソームの主な違いは何ですか?
- MSC(間葉系幹細胞)由来エクソソームは、特に組織修復能と免疫抑制能に優れている点が特徴です。線維芽細胞や免疫細胞由来のものと比較して、血管新生因子や抗炎症性miRNAを豊富に含んでおり、再生医療用途に最も適していると考えられています。
-
エクソソーム治療は、従来の幹細胞移植と比較してコスト面でどうなりますか?
- 初期の開発コストはかかりますが、長期的にはコストダウンが期待できます。細胞の維持管理が不要で、大量製造・凍結保存が可能であり、輸送コストも抑えられるため、将来的には「オフザシェルフ製剤」として、より安価に提供できる可能性があります。
-
DDSキャリアとして、リポソームとエクソソームの違いは何ですか?
- リポソームは合成脂質ですが、エクソソームは生体由来の膜タンパク質を持っています。そのため、免疫系からの回避能力(ステルス性)や、特定の細胞への指向性、細胞内への取り込み効率において、エクソソームの方が優れている場合が多いです。また、生体適合性が高く毒性が低い点も利点です。
-
現在、エクソソーム治療薬として承認されているものはありますか?
- 2024年現在、FDAやPMDAによって正式に承認され、一般販売されているエクソソーム医薬品はまだ存在しません。しかし、多くの候補物質が臨床試験(第I相〜第III相)の段階にあり、数年以内の承認が期待されています。
-
エクソソームの研究開発において、最も高いハードルは何ですか?
- 「高品質なエクソソームの大量製造」と「規格化(標準化)」です。細胞の状態によって分泌されるエクソソームの質が変化するため、均一な製品を安定して製造する技術の確立と、それを評価する試験法の標準化が最大の課題となっています。
<script type="application/ld+json">
{
"@context": "https://schema.org",
"@type": "FAQPage",
"mainEntity": [
{
"@type": "Question",
"name": "MSC由来エクソソームと他の細胞由来エクソソームの主な違いは何ですか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "MSC(間葉系幹細胞)由来エクソソームは、特に組織修復能と免疫抑制能に優れている点が特徴です。線維芽細胞や免疫細胞由来のものと比較して、血管新生因子や抗炎症性miRNAを豊富に含んでおり、再生医療用途に最も適していると考えられています。"
}
},
{
"@type": "Question",
"name": "エクソソーム治療は、従来の幹細胞移植と比較してコスト面でどうなりますか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "初期の開発コストはかかりますが、長期的にはコストダウンが期待できます。細胞の維持管理が不要で、大量製造・凍結保存が可能であり、輸送コストも抑えられるため、将来的には「オフザシェルフ製剤」として、より安価に提供できる可能性があります。"
}
},
{
"@type": "Question",
"name": "DDSキャリアとして、リポソームとエクソソームの違いは何ですか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "リポソームは合成脂質ですが、エクソソームは生体由来の膜タンパク質を持っています。そのため、免疫系からの回避能力(ステルス性)や、特定の細胞への指向性、細胞内への取り込み効率において、エクソソームの方が優れている場合が多いです。また、生体適合性が高く毒性が低い点も利点です。"
}
},
{
"@type": "Question",
"name": "現在、エクソソーム治療薬として承認されているものはありますか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "2024年現在、FDAやPMDAによって正式に承認され、一般販売されているエクソソーム医薬品はまだ存在しません。しかし、多くの候補物質が臨床試験(第I相〜第III相)の段階にあり、数年以内の承認が期待されています。"
}
},
{
"@type": "Question",
"name": "エクソソームの研究開発において、最も高いハードルは何ですか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "「高品質なエクソソームの大量製造」と「規格化(標準化)」です。細胞の状態によって分泌されるエクソソームの質が変化するため、均一な製品を安定して製造する技術の確立と、それを評価する試験法の標準化が最大の課題となっています。"
}
}
]
}
</script>